
Description
Les batteries sont des éléments centraux et chers dans les installations autonomes. Pourtant, leur fonctionnement et leur entretien sont très mal connus par le grand public. Ce tutoriel a donc plusieurs objectifs :
- Présenter le fonctionnement d'une batterie au plomb.
- Présenter les différents types de batteries au plomb
- Présenter les causes majeures de dégradation des batteries au plomb.
- Présenter les règles d'utilisations et d'entretien des batteries au plomb.
- Introduire le procédé de désulfatation (ou régénération) des batteries au plomb.
- Présenter le fonctionnement d'une batterie au plomb.
- Présenter les différents types de batteries au plomb
- Présenter les causes majeures de dégradation des batteries au plomb.
- Présenter les règles d'utilisations et d'entretien des batteries au plomb.
- Introduire le procédé de désulfatation (ou régénération) des batteries au plomb.
Introduction
Les batteries sont souvent les constituants les plus chers et les plus fragiles d’un système électrique de conversion. Aussi, il est important d’en prendre soin par une bonne utilisation et une bonne surveillance !
Les batteries au Plomb Acide sont très fragiles. Elles sont sensibles aux surcharges, aux charges partielles, aux décharges profondes, aux charges trop rapides et aux températures au-dessus 20°C. Tous ces facteurs de vieillissement prématuré, adviennent facilement et peuvent se combiner, ceci étant dû au manque de connaissance technique, à des systèmes mal dimensionnés ou à une utilisation erronée de la part de l’utilisateur. Si vous ne maîtrisez pas ces facteurs, les batteries seront rapidement endommagées.
Ces dommages amèneront à une durée de vie des batteries et à une disponibilité moindre et dans certains cas, une détérioration irrémédiable des batteries peut survenir. Les batteries dureront plus longtemps en les utilisant selon les règles de l’art, et donc leur remplacement sera moins fréquent. A long terme, vous ferez de sérieuses économies. Un autre intérêt est que le système de conversion sera bien plus performant si les batteries sont en bon état. Plus les batteries seront en bon état et plus l’installation sera performante !
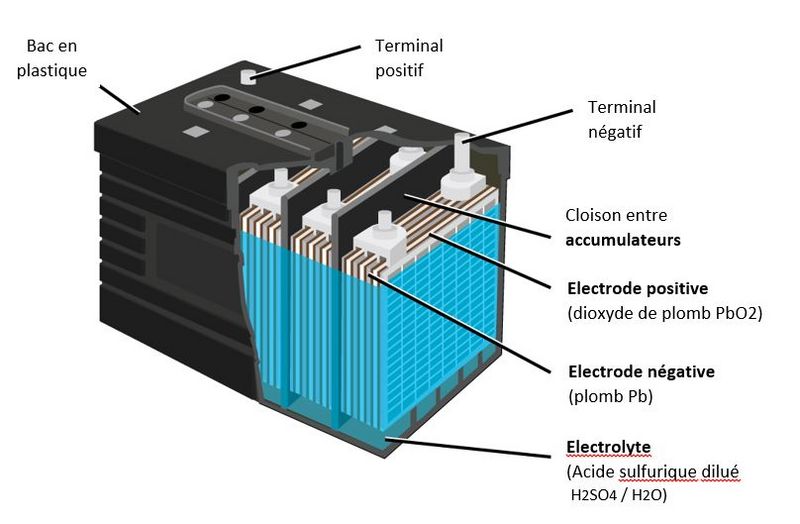
Étape 1 - Constitution d'une batterie au plomb
- Une batterie au plomb est constituée par un ensemble d'accumulateurs. La tension nominale d'un accumulateur étant d'environ 2.1 V, une batterie de 12 V est constituée de 6 accumulateurs montés en série et reliés par des connexions en plomb soudées. Ces accumulateurs sont logés dans un bac en plastique, fermé par un couvercle scellé.
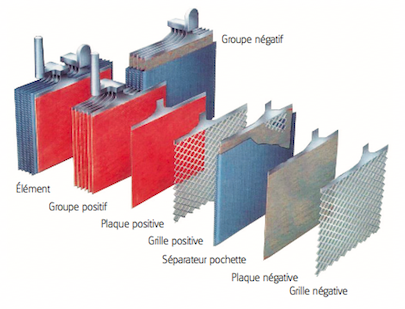
- Chaque accumulateur est composé d'un ensemble de couples d'électrodes positives et négatives montés en parallèle. Au milieu de chaque couple est placé un séparateur.
- Des séparateurs sont généralement des feuilles rectangulaires, intercalées entre les plaques positives et les plaques négatives, et possèdent des qualités remarquables:
- isolant électrique parfait
- très grande perméabilité aux ions porteurs de charges électriques
- excellente tenue à l'acide sulfurique
- Les électrodes sont composées d'une grille sur laquelle est déposée une matière active poreuse: du plomb (Pb) sur l'électrode négative et du dioxyde de plomb (PbO2) sur l'électrode positive. La grille collecte le courant et sert aussi de support mécanique de la matière active.
- L'électrolyte est une solution diluée d'acide sulfurique dans laquelle baigne les électrodes. Il peut être sous forme liquide, de gel ou absorbée dans des feutres en fibre de verre en fonction du type de batterie.
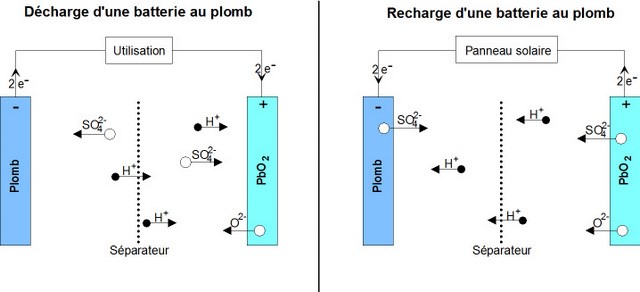
Étape 2 - Fonctionnement d'une batterie au plomb
Pour comprendre les causes de défaillance d'une batterie, il est important de bien comprendre les réactions chimiques à l’œuvre à l'intérieur de celle-ci.
- A la décharge: Lors de la décharge, il se passe la réaction chimique suivante:
PbO2 sol + Pb sol + 2 HSO4−aq + 2 H+aq ⟶ 2 PbSO4 sol + 2 H2O liq
- L'électrode positive (+) qui était du dioxyde de plomb va devenir du sulfate de plomb, sous forme de cristaux.
- L'électrode négative (-) qui était en plomb va aussi devenir du sulfate de plomb, sous forme de cristaux.
- Le bain dans lequel baigne tout ça (l'électrolyte) se transforme en grande partie en eau (H2O).
- A la charge : Lors de la charge, on force la réaction chimique inverse :
2PbSO4 sol + 2 H2O liq ⟶ Pb sol + PbO2 sol + 2 HSO4−aq + 2 H+aq.
- Les cristaux de sulfate de plomb se redissolvent. On retrouve une électrode (+) en dioxyde plomb et une électrode (-) en plomb.
- L'électrolyte redevient de l'acide sulfurique dilué.
Étape 3 - Différents types de batteries pour différents usages
Les batteries en fonction de leur usage :
- Batterie de démarrage:
Une batterie de démarrage est destinée à fournir un courant élevé pendant une très courte période. Elle est conçue pour démarrer un moteur (par exemple un véhicule ou un groupe électrogène). Les batteries de démarrage sont parfois appelées “batterie de voiture”, “batterie de camion” ou “batterie à plaques minces”. Voir l'intérieur d'une batterie de démarrage.
- Batterie de traction
Le nom de ces batteries vient de leur première utilisation : l’alimentation du moteur de véhicules électriques comme les chariots élévateurs. Elles sont conçues pour se recharger rapidement et résister à des décharges assez profondes. Elles sont bien adaptées pour une utilisation en solaire photovoltaïque.
- Batterie stationnaire
Ces batteries sont celles utilisées dans les alimentations de secours notamment pour des systèmes informatiques ou de télécommunication. Elles sont conçues pour être rechargées en permanence et n’être déchargées que rarement, elle ne sont donc prévues que pour un nombre réduit de cycles.
- Batterie solaire / à décharge lente
Ces batteries sont prévues pour être utilisées dans des installations solaires photovoltaïques. Elles sont conçues pour supporter un nombre élevé de cycle (puisqu’elles seront déchargées toutes les nuits et rechargées tous les matins), leur profondeur de décharge est généralement bonne mais peut varier fortement d’un modèle à l’autre. Les batteries de servitudes présentent à peu près les mêmes caractéristiques que les batteries solaires.
Voir l'intérieur d'une batterie à décharge lente / solaire
Les batteries en fonction de leur technologie d'électrolyte
- Batterie ouverte
Une batterie ouverte est une batterie à électrolyte liquide dotée de bouchons permettant de la remplir. Les batteries ouvertes ne sont pas étanches : le liquide qui est à l'intérieur s'évapore peu à peu, il faut donc contrôler régulièrement son niveau et compléter si nécessaire avec de l'eau distillée.
| Avantages | Inconvénients |
|---|---|
| Réparable | Entretien nécessaire |
| Permet les courants forts à froid (CCA) | Risque de non homogénéité de l'électrolyte si peu utilisé = vieillissement prématuré |
| Supporte les surcharges et les surchauffes (on peut remettre du liquide si celui-ci s'évapore) | Dégagement d'hydrogène, donc risque d'explotion si milieu non aéré |
| N'aime pas le froid, risque de gèle de l'électrolyte. | |
| Forte autodécharge (10-12% par mois) si pas utilisé régulièrement. | |
| Fuites possibles si basculée |
- Batterie liquide scellée / étanche
Une batterie étanche est une batterie à électrolyte liquide dotée d'un système permettant d’empêcher l'évaporation, par recombinaison des gaz. Ces batteries ne nécessitent pas de maintenance. Ces batteries sont souvent appelées VRLA pour Valve Regulated Lead-Acid.
| Avantages | Inconvénients |
|---|---|
| Réduit la production de gaz explosif, les pertes en eau et les fuites | Ne permet plus l'entretien, ni le contrôle |
| Nécessite moins de maintenance | Impose une charge parfaitement régulée en fonction de la température pour éviter les pertes de gaz par surpression |
- Batterie AGM
Les batteries AGM sont un type de batterie étanche / VRLA. Dans une batterie AGM, l'électrolyte est liquide mais maintenu en place dans un buvard en fibre de verre, d'où son nom: Absorbed Glass Material.
| Avantages | Inconvénients |
|---|---|
| Sans entretien avec un faible dégagement gazeux | Ne supporte pas la chaleur et les surcharges (perte de l'électrolyte sous forme de gaz - effet définitif) |
| Bon maintient de l'homogénéité de l'électrolyte | Durée de vie limitée (trop d'acidité) |
| Supporte bien le froid car électrolyte homogène | |
| Permet de faire passer des courants de crête forts (CCA) | |
| Résiste bien aux chocs car tout est bien maintenu à l'intérieur | |
| Faible autodécharge (1-3% par mois) |
- Batterie gel
Les batteries gel sont un type de batterie étanche / VRLA. Dans une batterie gel, l'électrolyte est gélifié par ajout de silicate.
| Avantages | Inconvénients |
|---|---|
| Parfait maintien de l'homogénéité de l'electrolyte | |
| Faible autodécharge (1-3% par mois) | |
| Résiste bien aux chocs car tout est bien maintenu à l'intérieur | |
Draft
 Français
Français English
English Deutsch
Deutsch Español
Español Italiano
Italiano Português
Português