Description
The purpose of this tutorial is to make hand-held warmers. These can be heated up to around 50°C when activated, and can be used in the mountains, for example, to keep warm when hiking.
Sommaire
Sommaire
[masquer]- 1 Description
- 2 Sommaire
- 3 Introduction
- 4 Étape 1 - Calculating quantities
- 5 Étape 2 - Cleaning equipment
- 6 Étape 3 - Mixing reagents
- 7 Étape 4 - Heating, evaporation
- 8 Étape 5 - Filling
- 9 Étape 6 - Reloading warmers
- 10 Étape 7 - Use of warmers
- 11 Étape 8 - The theory of warmers
- 12 Étape 9 - Problématique non résolue
- 13 Notes et références
- 14 Commentaires
Introduction
When we go out in the mountains, we sometimes find ourselves exposed to the cold, particularly on the extremities of the body (hands, feet).
Some people really struggle to keep warm, and ski touring (to avoid the wasteful and environmentally-friendly ski lifts!) can become a real nightmare!
Some sports shops offer hand-heaters for a little extra comfort. These are small plastic containers that warm up to around 50°C when activated.
Some are reusable, for around 20€ a pair, while others are not, for around 15€ for 30.
In a complete low-tech approach, we should first ask ourselves about this need for comfort. But before we get there, and for those who may already have given this in-depth thought but still feel the need to have heaters, it's possible to make reusable (almost! See the discussion on the problems to be solved) and economical ones yourself (see the discussion on the problems to be solved). It's possible to make your own heaters that are reusable (almost! See discussion on the problems to be solved) and economical (that's confirmed!)!Étape 1 - Calculating quantities
Here are the quantities for one warmer ! The mass of vinegar depends on its concentration.
Quantity for one warmer
35g baking soda
| Concentration of vinegar [%] [g | Mass of vinegar [g] | Approximate volume of vinegar [mL |
| 6 | 415 | 415 |
| 8 | 315 | 315 |
| 10 | 250 | 250 |
| 12 | 210 | 210 |
| 14 | 180 | 180 |
| 16 | 155 | 155 |
These values are approximate. You can find out how to calculate them in the theoretical sections.
NB: The density of vinegar is very close to that of water, 1kg for 1L.
Étape 2 - Cleaning equipment
Making warmers involves doing chemistry, and chemistry doesn't take kindly to impurities. We strongly advise you to clean all utensils properly with soap and water. Particularly the containers of the heaters, as there's a risk of a little compote remaining in them if you choose the same ones as us!
Étape 3 - Mixing reagents
Safety
- Vinegar is irritating to the skin and very irritating to the eyes. Do not hesitate to wear safety goggles when mixing. Otherwise, watch out for splashes.
The first step consists of mixing the vinegar and bicarbonate of soda. To do this, start by pouring the right amount of vinegar into the pan. Then add the bicarbonate of soda "slowly". Stir until there is no more foam. This indicates that the chemical reaction is complete.
Point of vigilance
- Pour in the bicarbonate of soda slowly, as the reaction produces CO2 gas, causing the solution to foam.
- This stage takes time, but it's best to get to the end so that all the vinegar reacts. If there is any vinegar left over, be prepared to smell its nauseating odour during the next stage!
- The more warmers you make, the longer the reaction will take. For 5 heaters, you can expect about 20 minutes of mixing.
Étape 4 - Heating, evaporation
Safety
- The substance obtained from the reaction of vinegar and sodium bicarbonate is sodium ethanoate. This substance is irritating, so don't hesitate to wear safety goggles. Otherwise, be careful not to get any in your eyes.
- Slight risk of burns, possible small splashes if large quantities are used on a high-powered hob.
When the first stage is complete, we can put our saucepan on a high heat, the aim being to evaporate all the excess water. I say too much, because we'll need a little more water to get the right substance. When a very light film begins to appear on the surface, then the substance is ready, you need to stop heating.
Point of vigilance
- There's a lot of water to evaporate, so this stage takes a while (again, the more heaters you use, the longer it takes to evaporate).
- During this stage, nothing happens for a long time, but in the end everything happens very quickly. You need to be very careful as soon as the liquid becomes slightly cloudy and yellow.
- Generally, crystals will appear on the edges of the pan towards the end.
- If you inadvertently leave the liquid to heat for too long, it will solidify completely. In this case, turn off the heat and add water quickly (not too much, just enough to see all the solid become liquid again). You can then put it back on the heat, stirring to help the last crystals liquefy. Don't worry, the heaters will still work!
- Towards the end, a smell similar to that of a baked cake should appear. It's not unpleasant, but avoid sniffing it too much! It's best to be careful when playing chemist's apprentice! Even when you're handling substances that aren't very dangerous :)
Étape 5 - Filling
Safety
- Risk of burns, as the liquid to be poured into the warmer containers is very hot (around 100°C at first).
- If the liquid comes into contact with the skin at less than 60°C, it will solidify and heat up. It's very impressive because the solid sticks to the skin. Don't panic, a little water and it will go away on its own. However, don't take too long to rinse off with water to avoid burning yourself.
The aim of this step is to fill the containers of our heaters with the substance obtained in step 4.
Two people are needed for this stage, as it is difficult to hold the containers and pour at the same time.
The person holding the container can wear gloves to limit the risk of burns.
At this stage, a funnel is inserted into the containers and the contents of the saucepan are poured in gently.
Point of vigilance
- Leave a small air space in the warmer when pouring in the liquid. Be careful not to completely block the hole with the funnel, as this could cause the liquid to overflow and burn :(
- Between each warmers, stir the pan to mix the liquid and prevent the surface from solidifying.
- The liquid solidifies at around 58°C, so pour it in before it reaches this temperature, otherwise the funnel will be blocked. However, don't pour too quickly or you could get burnt. If the substance starts to cool too much, simply add a little water and repeat step 4.
- If the funnel is completely blocked, you can pour in some hot water and the solid will quickly become liquid and flow!
Étape 6 - Reloading warmers
The warmers are now ready to be loaded!
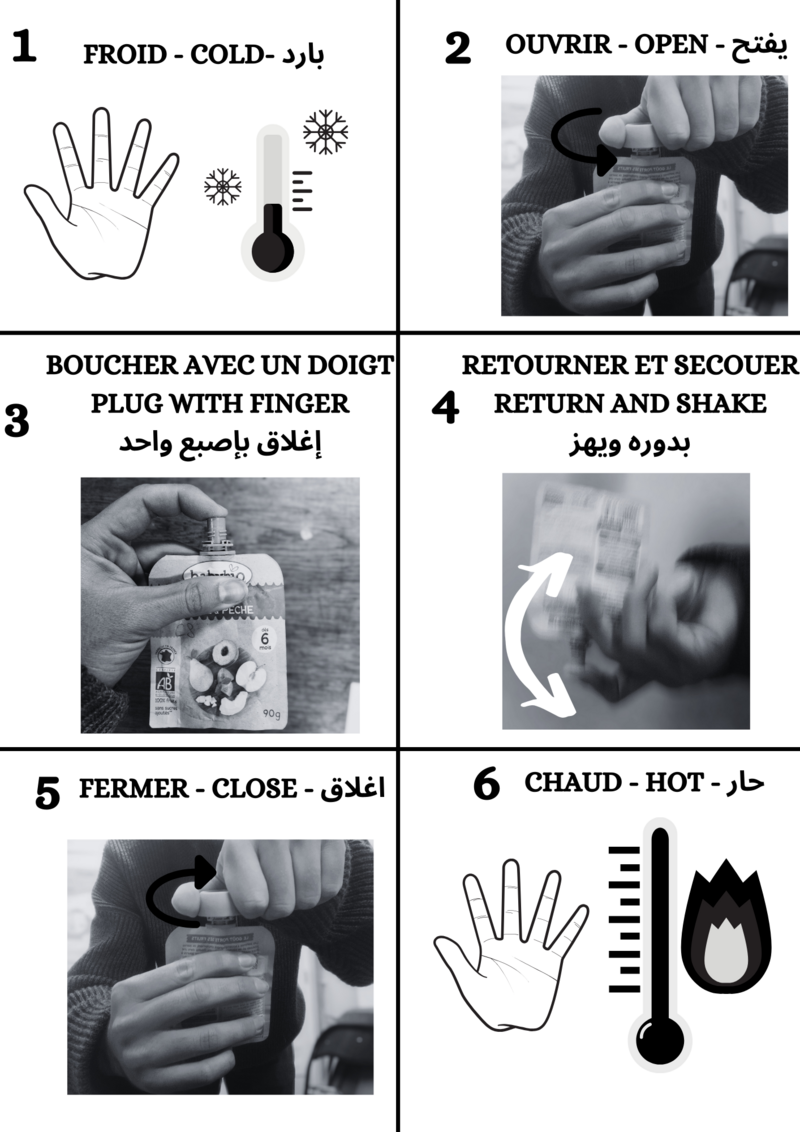
To charge the warmers with heat, place it in boiling water for 10-15 minutes. Then leave them to cool, without stirring them too much, until they reach room temperature.
They're now full of energy and ready for use in the mountains or anywhere else!
Étape 7 - Use of warmers
Once you're out in the mountains in the cold, you can activate them by following the instructions.
It then heats up to around 50°C. To keep the heat created, it is advisable to isolate them from the outside air by putting them in your gloves and/or pockets.
Safety
Warning: it is strongly inadvisable to heat up a frostbite suddenly. The use of heaters is preventive, to prevent a strong sensation of cold and not to heat an area in critical condition.
Then, it is not advisable to alternate between hot and cold for frostbite. It's better to wear dry clothes and wait for a bath thermostated at 37°C once you're in a safe place.
Étape 8 - The theory of warmers
It's been very interesting for me to experiment and improve a process following personal observations! I share with you my discoveries from my experiences and my readings.
Fabrication de l'éthanoate de sodium, réaction chimique
L'éthanoate de sodium est un produit de la réaction entre l'acide éthanoïque et le bicarbonate de sodium.
Cette réaction produit aussi de l'eau est du CO2.
Calcule des quantités
Cette partie n'est pas très fun, à passer si vous n'êtes pas un grand fan de calculs de chimie ! Mais nécessaire si vous voulez recalculer le tout par vous même !
Afin de déterminer les quantités d'acide éthanoïque et de bicarbonate de soude à mélanger on fait l'hypothèse que la réaction est totale. Ainsi, afin d'optimiser le tout, il faut mélanger les réactifs en quantité dite stœchiométrique. Lorsqu'on insère exactement ces quantités, tout les réactifs sont consommé et il ne reste plus que des produit à la fin de la réaction!
Dans notre cas, une molécule d'acide éthanoïque réagit avec une molécule de bicarbonate de sodium. Ainsi, il faut mettre le même nombre de "quantité de matière" (de moles) de chacun des deux réactifs afin d'atteindre les quantités stœchiométriques.
Sachant cela, on calcul la quantité de matière correspondante à 35g de bicarbonate (pour 1 chaufferette).
En suite, on calcul la masse d'acide acétique pour obtenir exactement la même quantité de matière (ce qui dépendra de sa masse molaire).
Enfin, sachant qu'un vinaigre, disons, à 8%, possède 0,08 g d'acide éthanoïque pour 100mL, alors on calcul le volume de vinaigre pour obtenir exactement la bonne masse d'acide éthanoïque.
Si on préfère, il est possible de calculer la masse de vinaigre plutôt que son volume (Utile lorsque l'on a pas de verre doseur). Par chance, le vinaigre à presque la masse volumique de l'eau, donc 1kg de vinaigre pour 1l de vinaigre.
Il a de nombreuse ressource pédagogique sur les calculs de base en chimie des solution sur internet si cela vous intéresse. Ce sont des notions aborder en début de lycée en France.
Comprendre par ses propres sens
Cette réaction est amusante à expérimenter car très visuel, la production de CO2 gazeux produit de la mousse. On peu alors savoir si toute nos molécules on bien réagi.
Pourquoi la réaction (mélange) est si longue ?
La réaction prend du temps, et on est obligé de mélanger ! Mais que se passe-t-il dans le monde des molécules pour que cela prenne autant de temps !
Dans notre casserole après quelques seconde de réaction, on a beaucoup d'eau, des réactifs mais aussi les quelques produits déjà créer. Pour pouvoir réagir, il faut que deux molécules de réactif se rencontre.
Mais comment ce rencontrer dans tout ce bazar !? C'est un peu comme si on jetait du pollen dans un champs de fleur, au début, il est facile pour le pollen de trouver une fleur célibataire, mais après quelques minutes, lorsque de nombreux couple se sont former, difficile pour une petite fleur et un pollen de ce retrouver.
En terme technique on parle de cinétique de réaction pour désigner la vitesse à laquelle elle à lieu et de phénomène limitant pour parler du phénomène qui impose cette vitesse.
Ici c'est la rencontre des molécules qui est la plus lente, on parle donc de transfert de masse.
Vous avez dit cristallisation ?
On a déjà discuter du problème de cristallisation si on fait chauffer trop longuement le liquide. C'est assez contre-intuitif comme observation. Normalement, en augmentant la température, on passe de solide à liquide pas l'inverse.
Le phénomène de cristallisation provient ici de la déshydratation l'éthanoate de sodium trihydraté vers l'éthanoate de sodium anhydre. En faite, la substance trihydraté, celle que l'on souhaite pour nos chaufferette, se liquéfie si on la chauffe au delà de 58°C. En revanche, la substance anhydre elle ne se liquéfie qu'à 324°C. Ainsi, lorsqu'on enlève son eau à une molécule, PAF ! Elle devient anhydre et se solidifie instantanément car nous ne somme bien en dessous de 324°C !
Au début, il y a de l'eau en excès, donc c'est cette eau la qui s'évapore. Mais dès lors qu'il n'y a presque plus d'eau, on commence à déshydrater nos bonne vieille molécule, d'où l'apparition sur la fin de cristaux, puis, progressivement d'un film solide.
Comprendre pour mieux agir !
Ici, la connaissance du phénomène permet de juger quand arrêter l'étapes 4. En effet, à l'apparition des premiers cristaux, on sait que le liquide restant n'est pas de l'eau mais bien de l'éthanoate de sodium trihydraté, car si il y avait encore de l'eau liquide, c'est elle qui s'évaporerais et aucun cristaux n'apparaitrais !
Le plus important ! Pourquoi les chaufferettes chauffe !
Le fonctionnement des chaufferettes se base sur le phénomène de surfusion ! Pour en savoir plus vous pouvez consulter cette article :
Étape 9 - Problématique non résolue
Des chaufferettes presque réutilisable !
Les chaufferettes devrait être réutilisable en théorie. Dans la réalité, à chaque nouvelle utilisation il devient plus difficile de les activer. Je n'ai pas su percé le mystère de ce phénomène mais peut être que vous y arriverez !
Elles sont tout de même réutilisable un certain nombre de fois si on accepte d'attendre un peu et de s'y reprendre à plusieurs fois pour les activer.
Pour les plus persistant, en insérant un tige en métal et en la malaxant l'activation est plus efficace donc vous pourrez les réutiliser plus longtemps avec cette méthode. Pour se faire vous pouvez insérer un l'embout d'un petit tourne vis, d'une vis ou tout objet métallique, le malaxer pendant un certain temps et le retirer une fois que la chaufferette se met à chauffer :)
Quelques auto-activations imprévues
Parfois, pendant la recharge, après les avoirs fait chauffer et une fois au repos. Les chaufferettes peuvent s'activer toute seul. Cela peut être embêtant car il faut alors les remettre à charger.
Pour s'assurer qu'une chaufferette est bien prête à utilisation il faut simplement vérifier qu'elle soit bien liquide. Si c'est le cas vous êtes sûr de votre coup.
Notes et références
Noé Beaupere. PILOTAGE DE LA LIBÉRATION DE CHALEUR ET ÉTUDE DU VIEILLISSEMENT DE MATÉRIAUX À CHANGEMENT DE PHASE. Sciences de l’ingénieur [physics]. Université d’Artois, 2019. Français. https://theses.hal.science/tel-03160528
Published








 Français
Français English
English Deutsch
Deutsch Español
Español Italiano
Italiano Português
Português