(Page créée avec « Recarga de calentadores ») |
(Page créée avec « Si le interesa, en Internet encontrará numerosos recursos didácticos sobre cálculos básicos en química de disoluciones. Se trata de una asignatura que se imparte al p... ») |
||
| (38 révisions intermédiaires par le même utilisateur non affichées) | |||
| Ligne 146 : | Ligne 146 : | ||
{{Tuto Step | {{Tuto Step | ||
|Step_Title=Recarga de calentadores | |Step_Title=Recarga de calentadores | ||
| − | |Step_Content= | + | |Step_Content=Los calentadores ya están listos para ser cargados. |
| − | + | Para cargar los calentadores de calor, colóquelos en agua hirviendo durante 10-15 minutos. Después, déjalos enfriar, sin removerlos demasiado, hasta que alcancen la temperatura ambiente. | |
| − | + | Ahora están llenos de energía y listos para usar en la montaña o en cualquier otro lugar. | |
<br /> | <br /> | ||
}} | }} | ||
{{Tuto Step | {{Tuto Step | ||
| − | |Step_Title= | + | |Step_Title=Uso de calentadores |
| − | |Step_Content= | + | |Step_Content=Una vez que estés en la montaña con frío, puedes activarlos siguiendo las instrucciones. |
| − | + | Después, se calienta hasta alcanzar unos 50°C. Para mantener el calor creado, conviene aislarlos del aire exterior metiéndolos en los guantes y/o bolsillos. | |
| − | ''' | + | '''Seguridad''' |
| − | + | Advertencia: es '''totalmente desaconsejable calentar bruscamente una zona congelada'''. El uso de calentadores es '''preventivo''', para evitar una fuerte sensación de frío y no para calentar una zona en estado crítico. | |
| − | + | No es aconsejable alternar frío y calor en caso de congelación. Es mejor llevar ropa seca y esperar a un baño termostatado a 37 °C una vez que estés en un lugar seguro. | |
| Ligne 174 : | Ligne 174 : | ||
}} | }} | ||
{{Tuto Step | {{Tuto Step | ||
| − | |Step_Title=La | + | |Step_Title=La teoría de los calentadores |
| − | |Step_Content= | + | |Step_Content=Ha sido muy interesante para mí experimentar y mejorar un proceso a raíz de observaciones personales. Me gustaría compartir con vosotros lo que he descubierto a través de mis experiencias y lecturas. |
| − | === | + | ===Fabricación de etanoato de sodio, reacción química=== |
| − | + | El etanoato de sodio es un producto de la reacción entre el ácido etanoico y el bicarbonato de sodio. | |
| − | + | Esta reacción también produce agua y CO2. | |
| − | ==== | + | ====Cálculo de cantidades==== |
| − | + | Esta parte no es muy divertida, así que sáltatela si no te gustan mucho los cálculos químicos. Pero es necesaria si quieres volver a calcularlo todo tú mismo. | |
| − | + | Para determinar las cantidades de ácido etanoico y bicarbonato sódico que hay que mezclar, partimos de la base de que la reacción es completa. Así que, para optimizarlo todo, necesitamos mezclar los reactivos en lo que se conoce como cantidades estequiométricas. Cuando se añaden exactamente estas cantidades, todos los reactivos se consumen y lo único que queda al final de la reacción es el producto. | |
| − | + | En nuestro caso, una molécula de ácido etanoico reacciona con una molécula de bicarbonato sódico. Por tanto, hay que añadir el mismo número de "cantidades de materia" (moles) de cada uno de los dos reactivos para alcanzar las cantidades estequiométricas. | |
| − | + | Sabiendo esto, calcula la cantidad de material correspondiente a 35 g de bicarbonato (para 1 calentador). | |
| − | + | Después, calcula la masa de ácido acético necesaria para obtener exactamente la misma cantidad de sustancia (que dependerá de su masa molar). | |
| − | + | Finalmente, sabiendo que, por ejemplo, el vinagre al 8% tiene 0,08g de ácido etanoico por 100mL, calculamos el volumen de vinagre para obtener exactamente la masa correcta de ácido etanoico. | |
| − | Si | + | Si lo prefieres, puedes calcular la masa de vinagre en lugar de su volumen (útil si no tienes un vaso medidor). Por suerte, el vinagre tiene casi la misma densidad que el agua, así que 1 kg de vinagre por 1 l de vinagre. |
| − | + | Si le interesa, en Internet encontrará numerosos recursos didácticos sobre cálculos básicos en química de disoluciones. Se trata de una asignatura que se imparte al principio de la enseñanza secundaria en Francia. | |
<br /> | <br /> | ||
| − | ==== | + | ==== Compréndelo con tus propios sentidos ==== |
| − | + | Es divertido experimentar con esta reacción porque es muy visual; la producción de CO2 gaseoso produce espuma. Entonces podremos saber si todas nuestras moléculas han reaccionado bien. | |
<br /> | <br /> | ||
| − | ==== | + | ====¿Por qué tarda tanto la reacción (mezcla)? ==== |
| − | La | + | La reacción lleva su tiempo, ¡y hay que mezclar! Pero, ¿qué ocurre en el mundo de las moléculas para que tarde tanto? |
| − | + | En nuestro cazo, tras unos segundos de reacción, tenemos mucha agua, los reactivos y también los pocos productos que ya se han creado. Para reaccionar, dos moléculas de reactivo deben encontrarse. | |
| − | + | Pero, ¿cómo encontrar a alguien en este lío? Es un poco como echar polen en un campo de flores, al principio es fácil que el polen encuentre una sola flor, pero al cabo de unos minutos, cuando se han formado muchas parejas, es difícil que una flor pequeña y un polen se encuentren. | |
| − | En | + | En términos técnicos, hablamos de '''cinética de reacción''' para referirnos a la velocidad a la que se produce la reacción y de '''fenómeno limitante''' para referirnos al fenómeno que impone esta velocidad. |
| − | + | Aquí lo más lento es el encuentro de las moléculas, por lo que se habla de '''transferencia de masa''' <br />. | |
| − | ==== | + | ====¿Ha dicho cristalización? ==== |
| − | + | Ya hemos hablado del problema de la cristalización si el líquido se calienta durante demasiado tiempo. Se trata de una observación bastante contraintuitiva. Normalmente, al aumentar la temperatura, se pasa de sólido a líquido, y no al revés. | |
| − | + | El fenómeno de la cristalización procede de la deshidratación del trihidrato de etanoato de sodio en etanoato de sodio anhidro. De hecho, la sustancia '''trihidratada''', la que queremos para nuestros calentadores, se licua si la calentamos por encima de los '''58°C'''. En cambio, la sustancia '''anhidra''' sólo se licua a '''324°C'''. Así que cuando se elimina el agua de una molécula, ¡PAF! Se convierte en anhidra y se solidifica instantáneamente, ¡porque estamos muy por debajo de 324°C! | |
| − | + | Al principio, hay un '''exceso de agua''', por lo que es esta agua la que se evapora. Pero en cuanto casi no queda agua, empezamos a '''deshidratar''' nuestra molécula, '''de ahí la aparición de cristales''' al final, seguidos gradualmente por '''una película sólida'''. | |
<br /> | <br /> | ||
| − | ==== | + | ==== Comprender para actuar mejor ==== |
| − | + | Aquí, el conocimiento del fenómeno permite juzgar cuándo detener el paso 4. En efecto, cuando aparecen los primeros cristales, sabemos que el líquido restante no es agua sino etanoato de sodio trihidrato, porque si todavía hubiera agua líquida, sería ¡el que se evaporaría y no aparecerían cristales! <br /> | |
| − | === | + | ===¡Lo más importante! ¡Por qué se calientan los calentadores!=== |
| − | + | ¡Los calentadores funcionan sobre la base del fenómeno del sobrefusión | |
| + | ! Para saber más, lee este artículo: | ||
https://ssaft.com/Blog/dotclear/?pages/Acetate-de-Sodium | https://ssaft.com/Blog/dotclear/?pages/Acetate-de-Sodium | ||
| Ligne 235 : | Ligne 236 : | ||
}} | }} | ||
{{Tuto Step | {{Tuto Step | ||
| − | |Step_Title= | + | |Step_Title=Cuestiones sin resolver |
| − | |Step_Content==== | + | |Step_Content====¡Los calentadores son casi reutilizables!=== |
| − | + | En teoría, los calentadores deberían ser reutilizables. En realidad, cada vez que se utilizan resulta más difícil activarlos. No he sido capaz de resolver el misterio de este fenómeno, ¡pero quizá tú sí puedas! | |
| − | + | Sin embargo, se pueden reutilizar varias veces si se está dispuesto a esperar un tiempo y repasarlas varias veces para activarlas. | |
| − | + | Para los más persistentes, al introducir una varilla de metal y amasarla la activación es más efectiva por lo que podrás reutilizarlos por más tiempo con este método. Para ello puedes introducir la punta de un destornillador pequeño, un tornillo o cualquier objeto metálico, amasarlo un rato y retirarlo una vez que el calentador empiece a calentarse :) | |
<br /> | <br /> | ||
| − | === | + | ===Algunas autoactivaciones inesperadas=== |
| − | + | A veces durante la recarga, después de haberlos calentado y una vez en reposo. Los calentadores pueden activarse solos. Esto puede ser molesto porque entonces tienes que cargarlos de nuevo. | |
| − | + | Para estar seguro de que un calentador está listo para usar, basta con comprobar que está líquido. Si es así, estás en el lado seguro. | |
}} | }} | ||
{{Notes | {{Notes | ||
| − | |Notes=Noé Beaupere. | + | |Notes=Noé Beaupere. CONTROL DE LA LIBERACIÓN DE CALOR Y ESTUDIO DEL ENVEJECIMIENTO DE LOS MATERIALES DE CAMBIO DE FASE. Ciencias de la ingeniería [física]. Universidad de Artois, 2019. Francés. https://theses.hal.science/tel-03160528 |
}} | }} | ||
{{PageLang | {{PageLang | ||
Version du 13 août 2024 à 16:09
Description
El objetivo de este tutorial es fabricar calentadores portátiles. Se pueden calentar hasta unos 50 °C cuando se activan, y se pueden utilizar en la montaña, por ejemplo, para mantener el calor durante una excursión.
Sommaire
Sommaire
- 1 Description
- 2 Sommaire
- 3 Introduction
- 4 Étape 1 - Calcular cantidades
- 5 Étape 2 - Limpieza del equipo
- 6 Étape 3 - Mezclado de reactivos
- 7 Étape 4 - Calentamiento, evaporación
- 8 Étape 5 - Llenado
- 9 Étape 6 - Recarga de calentadores
- 10 Étape 7 - Uso de calentadores
- 11 Étape 8 - La teoría de los calentadores
- 12 Étape 9 - Cuestiones sin resolver
- 13 Notes et références
- 14 Commentaires
Introduction
Cuando salimos a la montaña, a veces nos encontramos expuestos al frío, sobre todo en las extremidades del cuerpo (manos, pies).
Algunas personas realmente luchan por mantener el calor, y esquiar (para evitar los remontes mecánicos que no son muy económicas ni respetuosas con el medio ambiente) puede convertirse en un verdadero calvario.
Algunas tiendas de deportes ofrecen calentadores de manos para mayor comodidad. Se trata de pequeños recipientes de plástico que se calientan hasta unos 50 °C cuando se activan.
Algunos son reutilizables, por unos 20 euros el par, mientras que otros no lo son, por unos 15 euros los 30.
En un planteamiento completamente low-tech, deberíamos preguntarnos primero por esta necesidad de confort. Pero antes de llegar ahí, y para aquellos que ya hayan reflexionado en profundidad sobre este tema pero sigan sintiendo la necesidad de tener calefactores. Es posible fabricar calentadores reutilizables (¡casi! Véase la discusión sobre los problemas a resolver) y económicos (¡confirmado!).Étape 1 - Calcular cantidades
Estas son las cantidades para un calentador. La masa de vinagre depende de su concentración.
Cantidad para un calentador
35g de bicarbonato sódico
| Concentración de vinagre [%] [g] | Masa de vinagre [g] | Volumen aproximado de vinagre [mL] |
| 6 | 415 | 415 |
| 8 | 315 | 315 |
| 10 | 250 | 250 |
| 12 | 210 | 210 |
| 14 | 180 | 180 |
| 16 | 155 | 155 |
Estos valores son aproximados. Puedes consultar cómo calcularlos en las secciones teóricas.
Nota: La densidad del vinagre es muy parecida a la del agua, es decir, 1 kg por 1 l.
Étape 2 - Limpieza del equipo
La fabricación de calentadores es similar al química, y a la química no le gustan las impurezas. Le aconsejamos encarecidamente que limpie bien todos los utensilios con agua y jabón. Sobre todo los recipientes de los calentadores, ya que existe el riesgo de que quede un poco de compota en ellos si eliges los mismos que nosotros.
Étape 3 - Mezclado de reactivos
Seguridad
- El vinagre es irritante para la piel y muy irritante para los ojos. No dude en utilizar gafas de seguridad al mezclarlo. Además, tenga cuidado con las salpicaduras.
El primer paso es mezclar el vinagre y el bicarbonato de sodio. Para ello, empieza por servir la cantidad adecuada de vinagre en el cazo. Entonces, añade el bicarbonato poco a poco. Remueve hasta que deje de salir espuma. Esto indica que la reacción química se ha completado.
Punto de vigilancia
- Servir el bicarbonato de sodio lentamente, ya que la reacción produce CO2 gaseoso, lo que hace que la solución haga espuma.
- Este paso lleva su tiempo, pero es mejor llegar hasta el final para que todo el vinagre reaccione. Si sobra vinagre, ¡prepárate para oler su nauseabundo olor durante la siguiente etapa!
- Cuantos más calentadores hagas, más tardará la reacción. Para 5 calentadores, puedes esperar unos 20 minutos de mezcla.
Étape 4 - Calentamiento, evaporación
Seguridad
- La sustancia obtenida de la reacción del vinagre y el bicarbonato sódico es el etanoato sódico. Esta sustancia es irritante, así que no dudes en ponerte gafas protectoras. En caso contrario, tenga cuidado de que no le entre nada en los ojos.
- Ligero riesgo de quemaduras, posibles pequeñas salpicaduras si se utilizan grandes cantidades en una placa de cocción de alta potencia.
Una vez completado el primer paso, podemos poner nuestro cazo a fuego fuerte, con el objetivo de evaporar todo el agua sobrante. Digo sobrante, porque necesitaremos un poco más de agua para obtener la sustancia adecuada. Cuando empiece a aparecer una película muy ligera en la superficie, entonces la sustancia estará lista, hay que dejar de calentar.
Punto de vigilancia
- Hay mucha agua que evaporar, por lo que este paso lleva un tiempo (de nuevo, cuantos más calentadores utilices, más tardará en evaporarse).
- Durante este paso, no ocurre nada durante mucho tiempo, pero al final todo ocurre muy rápidamente. Hay que tener mucho cuidado en cuanto el líquido se vuelve ligeramente turbio y amarillo.
- Generalmente, aparecerán cristales en los bordes del cazo hacia el final.
- Si por descuido dejas el líquido al fuego durante demasiado tiempo, se solidificará por completo. En este caso, apague el fuego y añada agua rápidamente (no demasiada, sólo la suficiente para ver que todo el sólido vuelve a ser líquido). Entonces, vuelve a ponerlo al fuego, removiendo para ayudar a licuar los últimos cristales. No te preocupes, ¡los calentadores seguirán funcionando!
- Hacia el final, debería aparecer un olor parecido al de un pastel horneado. No es desagradable, ¡pero evita olerlo demasiado! Es mejor tener cuidado cuando juegas a ser aprendiz de químico. Incluso cuando manipules sustancias que no son muy peligrosas :)
Étape 5 - Llenado
Seguridad
- Riesgo de quemaduras, ya que el líquido que se sierve en los recipientes calentadores está muy caliente (alrededor de 100°C al principio).
- Si el líquido entra en contacto con la piel a menos de 60°C, se solidifica y se calienta. Es muy impresionante porque el sólido se pega a la piel. No te asustes, con un poco de agua desaparecerá solo. No obstante, no tardes demasiado en aclararte con agua para evitar quemarte.
El objetivo de este paso es llenar los recipientes de nuestros calentadores con la sustancia obtenida en el paso 4.
Se necesitan dos personas para este paso, ya que es difícil sujetar los recipientes y servir al mismo tiempo.
La persona que sostiene el recipiente puede llevar guantes para limitar el riesgo de quemaduras.
En este paso, se introduce un embudo en los recipientes y se sierve suavemente el contenido del cazo.
Punto de vigilancia
- Tenga cuidado de no tapar completamente el orificio con el embudo, ya que podría hacer que el líquido rebosara y se quemara :(
- Revuelva el cazo entre cada calentador para mezclar el líquido y evitar que la superficie se solidifique.
- El líquido se solidifica a unos 58°C, así que siervelo antes de que alcance esta temperatura, de lo contrario el embudo se bloqueará. Sin embargo, no lo sierves demasiado rápido o podrías quemarte. Si la sustancia empieza a enfriarse demasiado, simplemente añade un poco de agua y repite el paso 4.
- Si el embudo se bloquea por completo, puedes verter un poco de agua caliente y el sólido se convertirá rápidamente en líquido y fluirá
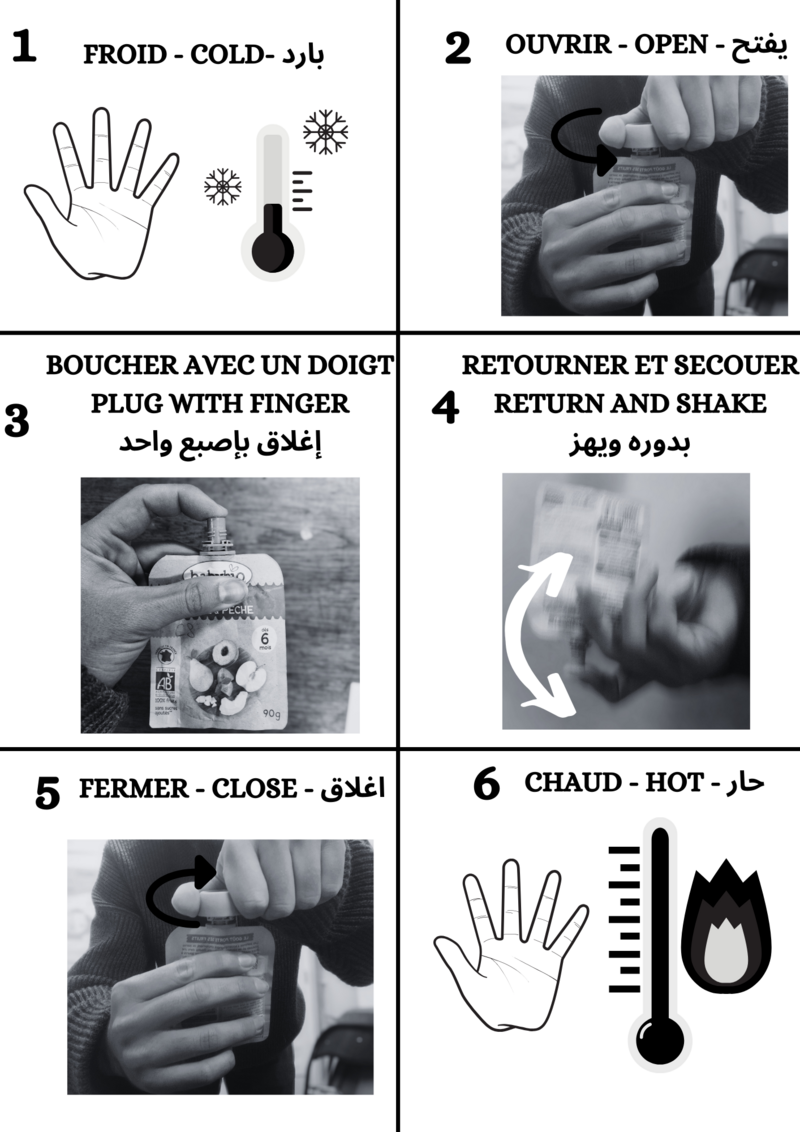
Étape 6 - Recarga de calentadores
Los calentadores ya están listos para ser cargados.
Para cargar los calentadores de calor, colóquelos en agua hirviendo durante 10-15 minutos. Después, déjalos enfriar, sin removerlos demasiado, hasta que alcancen la temperatura ambiente.
Ahora están llenos de energía y listos para usar en la montaña o en cualquier otro lugar.
Étape 7 - Uso de calentadores
Una vez que estés en la montaña con frío, puedes activarlos siguiendo las instrucciones.
Después, se calienta hasta alcanzar unos 50°C. Para mantener el calor creado, conviene aislarlos del aire exterior metiéndolos en los guantes y/o bolsillos.
Seguridad
Advertencia: es totalmente desaconsejable calentar bruscamente una zona congelada. El uso de calentadores es preventivo, para evitar una fuerte sensación de frío y no para calentar una zona en estado crítico.
No es aconsejable alternar frío y calor en caso de congelación. Es mejor llevar ropa seca y esperar a un baño termostatado a 37 °C una vez que estés en un lugar seguro.
Étape 8 - La teoría de los calentadores
Ha sido muy interesante para mí experimentar y mejorar un proceso a raíz de observaciones personales. Me gustaría compartir con vosotros lo que he descubierto a través de mis experiencias y lecturas.
Fabricación de etanoato de sodio, reacción química
El etanoato de sodio es un producto de la reacción entre el ácido etanoico y el bicarbonato de sodio.
Esta reacción también produce agua y CO2.
Cálculo de cantidades
Esta parte no es muy divertida, así que sáltatela si no te gustan mucho los cálculos químicos. Pero es necesaria si quieres volver a calcularlo todo tú mismo.
Para determinar las cantidades de ácido etanoico y bicarbonato sódico que hay que mezclar, partimos de la base de que la reacción es completa. Así que, para optimizarlo todo, necesitamos mezclar los reactivos en lo que se conoce como cantidades estequiométricas. Cuando se añaden exactamente estas cantidades, todos los reactivos se consumen y lo único que queda al final de la reacción es el producto.
En nuestro caso, una molécula de ácido etanoico reacciona con una molécula de bicarbonato sódico. Por tanto, hay que añadir el mismo número de "cantidades de materia" (moles) de cada uno de los dos reactivos para alcanzar las cantidades estequiométricas.
Sabiendo esto, calcula la cantidad de material correspondiente a 35 g de bicarbonato (para 1 calentador).
Después, calcula la masa de ácido acético necesaria para obtener exactamente la misma cantidad de sustancia (que dependerá de su masa molar).
Finalmente, sabiendo que, por ejemplo, el vinagre al 8% tiene 0,08g de ácido etanoico por 100mL, calculamos el volumen de vinagre para obtener exactamente la masa correcta de ácido etanoico.
Si lo prefieres, puedes calcular la masa de vinagre en lugar de su volumen (útil si no tienes un vaso medidor). Por suerte, el vinagre tiene casi la misma densidad que el agua, así que 1 kg de vinagre por 1 l de vinagre.
Si le interesa, en Internet encontrará numerosos recursos didácticos sobre cálculos básicos en química de disoluciones. Se trata de una asignatura que se imparte al principio de la enseñanza secundaria en Francia.
Compréndelo con tus propios sentidos
Es divertido experimentar con esta reacción porque es muy visual; la producción de CO2 gaseoso produce espuma. Entonces podremos saber si todas nuestras moléculas han reaccionado bien.
¿Por qué tarda tanto la reacción (mezcla)?
La reacción lleva su tiempo, ¡y hay que mezclar! Pero, ¿qué ocurre en el mundo de las moléculas para que tarde tanto?
En nuestro cazo, tras unos segundos de reacción, tenemos mucha agua, los reactivos y también los pocos productos que ya se han creado. Para reaccionar, dos moléculas de reactivo deben encontrarse.
Pero, ¿cómo encontrar a alguien en este lío? Es un poco como echar polen en un campo de flores, al principio es fácil que el polen encuentre una sola flor, pero al cabo de unos minutos, cuando se han formado muchas parejas, es difícil que una flor pequeña y un polen se encuentren.
En términos técnicos, hablamos de cinética de reacción para referirnos a la velocidad a la que se produce la reacción y de fenómeno limitante para referirnos al fenómeno que impone esta velocidad.
Aquí lo más lento es el encuentro de las moléculas, por lo que se habla de transferencia de masa
.
¿Ha dicho cristalización?
Ya hemos hablado del problema de la cristalización si el líquido se calienta durante demasiado tiempo. Se trata de una observación bastante contraintuitiva. Normalmente, al aumentar la temperatura, se pasa de sólido a líquido, y no al revés.
El fenómeno de la cristalización procede de la deshidratación del trihidrato de etanoato de sodio en etanoato de sodio anhidro. De hecho, la sustancia trihidratada, la que queremos para nuestros calentadores, se licua si la calentamos por encima de los 58°C. En cambio, la sustancia anhidra sólo se licua a 324°C. Así que cuando se elimina el agua de una molécula, ¡PAF! Se convierte en anhidra y se solidifica instantáneamente, ¡porque estamos muy por debajo de 324°C!
Al principio, hay un exceso de agua, por lo que es esta agua la que se evapora. Pero en cuanto casi no queda agua, empezamos a deshidratar nuestra molécula, de ahí la aparición de cristales al final, seguidos gradualmente por una película sólida.
Comprender para actuar mejor
Aquí, el conocimiento del fenómeno permite juzgar cuándo detener el paso 4. En efecto, cuando aparecen los primeros cristales, sabemos que el líquido restante no es agua sino etanoato de sodio trihidrato, porque si todavía hubiera agua líquida, sería ¡el que se evaporaría y no aparecerían cristales!
¡Lo más importante! ¡Por qué se calientan los calentadores!
¡Los calentadores funcionan sobre la base del fenómeno del sobrefusión ! Para saber más, lee este artículo:
Étape 9 - Cuestiones sin resolver
¡Los calentadores son casi reutilizables!
En teoría, los calentadores deberían ser reutilizables. En realidad, cada vez que se utilizan resulta más difícil activarlos. No he sido capaz de resolver el misterio de este fenómeno, ¡pero quizá tú sí puedas!
Sin embargo, se pueden reutilizar varias veces si se está dispuesto a esperar un tiempo y repasarlas varias veces para activarlas.
Para los más persistentes, al introducir una varilla de metal y amasarla la activación es más efectiva por lo que podrás reutilizarlos por más tiempo con este método. Para ello puedes introducir la punta de un destornillador pequeño, un tornillo o cualquier objeto metálico, amasarlo un rato y retirarlo una vez que el calentador empiece a calentarse :)
Algunas autoactivaciones inesperadas
A veces durante la recarga, después de haberlos calentado y una vez en reposo. Los calentadores pueden activarse solos. Esto puede ser molesto porque entonces tienes que cargarlos de nuevo.
Para estar seguro de que un calentador está listo para usar, basta con comprobar que está líquido. Si es así, estás en el lado seguro.
Notes et références
Noé Beaupere. CONTROL DE LA LIBERACIÓN DE CALOR Y ESTUDIO DEL ENVEJECIMIENTO DE LOS MATERIALES DE CAMBIO DE FASE. Ciencias de la ingeniería [física]. Universidad de Artois, 2019. Francés. https://theses.hal.science/tel-03160528
Published








 Français
Français English
English Deutsch
Deutsch Español
Español Italiano
Italiano Português
Português