(Page créée avec « Grain inoculation: day 3 ») |
(Page créée avec « The liquid inoculation is carried out on the clean substrate. Either the substrate is in a jar (as in the pictures) or the substrate is contained in a grow bag. In both ca... ») |
||
| Ligne 239 : | Ligne 239 : | ||
{{Tuto Step | {{Tuto Step | ||
|Step_Title=Grain inoculation: day 3 | |Step_Title=Grain inoculation: day 3 | ||
| − | |Step_Content= | + | |Step_Content=The liquid inoculation is carried out on the clean substrate. Either the substrate is in a jar (as in the pictures) or the substrate is contained in a grow bag. In both cases, the mycelium must be able to breathe. |
Version du 29 avril 2022 à 09:38
Description
Discover how easy it is to grow mushrooms! Easy and quick to set up, liquid inoculation consists of depositing a liquid culture on a substrate. The mycelium will propagate during the incubation phase. It is then possible to move on to the fruiting phase to pick the mushrooms.
Sommaire
Sommaire
- 1 Description
- 2 Sommaire
- 3 Introduction
- 4 Video d'introduction
- 5 Étape 1 - Preparation
- 6 Étape 2 - Optional, copy of a liquid culture: manufacture of the jar for inoculation
- 7 Étape 3 - Optional, liquid culture copy
- 8 Étape 4 - Grain inoculation: the rinse, day 1
- 9 Étape 5 - Grain inoculation: sterilization, day 2
- 10 Étape 6 - Grain inoculation: day 3
- 11 Étape 7 - Transfert de grains : clonage ou fructification
- 12 Étape 8 - Préparation de votre substrat (dès que vos grains sont bien colonisés)
- 13 Étape 9 - Transfert des grains
- 14 Commentaires
Introduction
In this tutorial, we are going to learn how to use a mycelium syringe in liquid culture. One of the prerequisites is therefore to have a syringe of liquid culture of the mushroom variety of your choice. It is possible to provide it on the link following. Tutorial produced in partnership with the company Breizh Bell, a company in myciculture and low-tech production of organic mushrooms, in France.
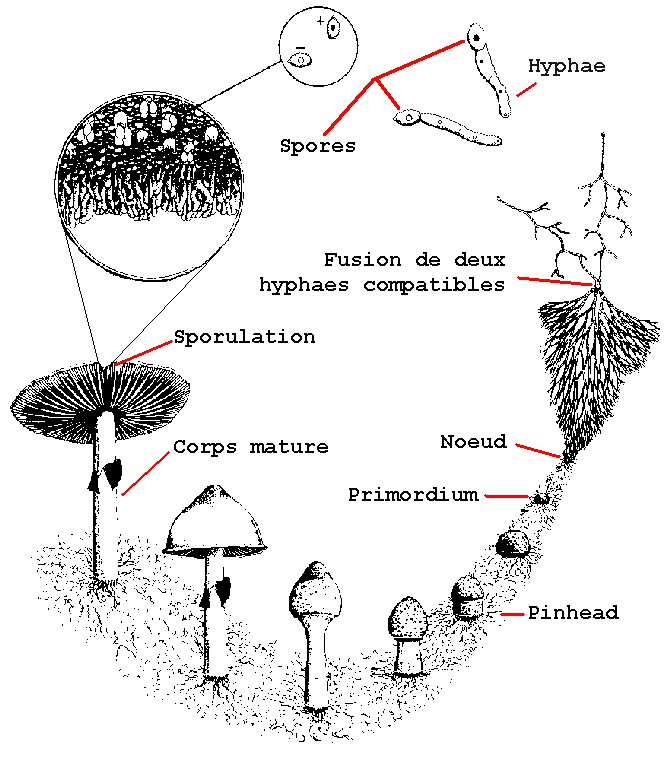
Introduction to the mushroom cycle
What is commonly called "mushroom" is in fact only the temporary and visible "fruiting body": the sporophore (formerly called "carpophore").
It is the result of an organism with a more durable and more discreet character, formed of filaments generally invisible to the naked eye when they are isolated: the A9lium mycelium.
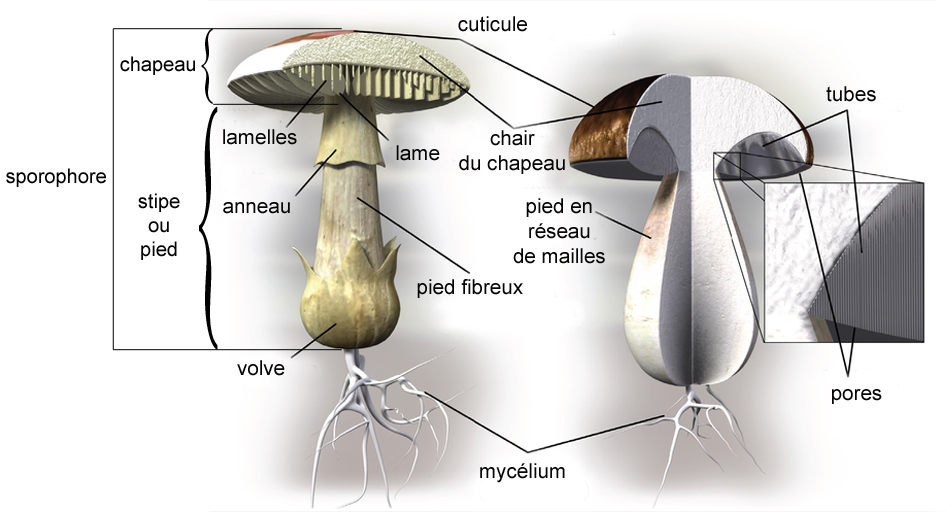
The sporophore is often in the form of a foot wearing a hat .
To cultivate a mushroom, we try to reproduce the natural external conditions. Mushroom cultivation is divided into three main stages.
- Inoculation: addition of mycelium (in the form of spores or in liquid or agar culture) in the substrate
- Incubation: the mycelium propagates in the substrate
- Fructification: the mycelium wants to reproduce by forming a sporophore
Liquid inoculation?
In myciculture, inoculation by liquid culture consists of injecting mycelium contained in sterilized sugar water onto a substrate.
Why is it awesome?
There are several ways to start a mushroom crop. Liquid inoculation is one of the easiest because you just need to spray a substrate with a liquid culture. In addition, the risk of contamination is less than with other methods.
Receiving the liquid inoculation syringe
Upon receipt of the syringe containing the mycelium, place it immediately in the refrigerator, it must be used within two weeks!
You have two choices :
- Liquid culture copy: The goal is to copy the liquid culture to achieve even more culture! The liquid culture copy is optional!
- Grain inoculation: This consists of depositing a liquid culture on a substrate. Seed inoculation can be done in a jar or in a bag
Glossary :
Mycelium: filamentous body of the fungus
Inoculation: injection of the mycelium into the substrate
Liquid culture: mixture of sterilized sugar water with mycelium
Substrate: Food of the fungus (grains, straw, wood...), the mycelium attaches to the substrateYoutube
Matériaux
(Liquid Mycelium syringe: Namekos, blue oyster mushroom, gray oyster mushroom, yellow oyster mushroom, pink oyster mushroom, shiitake mushrooms, red wine stropharia, etc.)
– Pairs of talc-free gloves and masks.
– Charlotte or clean cap (the swimming pool ones are tops!).
– Tealight candles (Minimum 10 to 20)
- Sterile compresses
Lab equipment
- Paper towels
– Alcohol 70°
Equipment for liquid culture:
- A jar and its lid
- A drill and drill bits
- Un bouchon auto refermable & un bouchon filtrant
- High temperature transparent silicone seal tube
- Aluminum foil
- water and beet sugar
Outils
– Thermometer
- Measuring cup
- Pair of scissors
– Clothespins (wooden recommended)
– Large saucepan/pressure cooker or oven.
– Vaporizer
Étape 1 - Preparation
It is very important to have the most sterile conditions possible, throughout the manipulations. Indeed, there is a biological struggle between living species. If the environment is contaminated, the fungus will find itself in competition with other organisms, so it will be too fragile and will lose. We will seek to create ideal growing conditions to promote the fungus.
We advise you to place yourself in your kitchen, under your hood. It will prevent dust from settling on your crops.
- Clean your work surface and each potential contact area with 70° alcohol before each handling.
- Wash your hands and arms thoroughly with soap before each handling. You can also put on gloves and clean them with 70° alcohol.
- Tie your hair and/or put on your hat.
We strongly advise you to handle your liquid mycelium out of sunlight, under a soft and weak light (night light for example).
Étape 2 - Optional, copy of a liquid culture: manufacture of the jar for inoculation
In this step, we will make a jar for your liquid culture.
The lid of the jar will have two holes. They will be filled with two plugs.
The first stopper is self-closing and will allow the insertion of the syringe needle. The second is a filter cap for the respiration of the mycelium in the jar.
- Take a jar and make the two holes using a drill (be careful, the diameter is not the same!).
- Place a light dose of silicone gasket all around the hole of the filter cap
- Place the plugs in the holes with the appropriate diameters.
- Let the seal dry for a day
Your jar is ready for liquid inoculation!
Étape 3 - Optional, liquid culture copy
- Follow step 1 of this tutorial.
- Boil water in your saucepan.
- Take your previously prepared jar (see step 2), fill it with boiled water and unrefined beet sugar (volume 4% of the volume of water). Close your jar, cover it with aluminum foil, emphasizing the opening area of the lid.
- Fill your pot with water again and boil it.
- Place your wrapped jar in your saucepan and leave it covered for 2 hours (sterilization).
- In your kitchen, turn on your hood and clean your worktop with alcohol.
- Place tealights all around your work area.
- Light the candles and take your syringe of liquid mycelium out of the refrigerator, clean (alcohol 70°) and place it in the center of the work area.
- Take your syringe and needle out of their bag. Insert the needle.
- Take your jar of liquid culture, clean the outside of this jar with 70° alcohol and place it in your work area.
- Take two sterile compresses and soak them in alcohol.
- Take two sterile compresses and soak them in alcohol.
- Then place it between the two compresses soaked in alcohol.
- Completely empty the mycelium from your syringe into your jar.
- Wrap your jar with aluminum foil, fabric or paper
- Place it in an environment at 20°C and wait about two weeks. You can shake your jar to make your mycelium spread even more and take the opportunity to see its evolution
The mycelium will spread.
Your culture is good when your jar is filled with a cloud of mycelium! The slightest green, blue or black stain in your jar is a sign of contamination and your culture will then be unusable.
When the mycelium has spread well, we invite you to carry out an inoculation on the grains. The steps are described below
Étape 4 - Grain inoculation: the rinse, day 1
If you want to inoculate grains, they will have to be cleaned on the first day.
- Take out your grains and rinse them thoroughly with cold water, until clear water is obtained.
- Place these grains in a container.
- Take calcium carbonate (CaCO3) and add 2 to 5% of the weight of your grains.
- Fill this bag with hot tap water, slightly above the level of the beans.
- Close your container and let stand overnight.
Étape 5 - Grain inoculation: sterilization, day 2
- Boil water in your saucepan.
- Take out your container of beans and fill it with boiled water (below the level of the beans).
- Fill your vaporizer with the rest of this cooled water.
- Fill your pot with water again and bring to the boil.
- Close the container of your grains and immerse it in your saucepan/pressure cooker.
- Let it boil for 3 hours in your pan, covered.
- Take your container out of the pan and let it cool overnight.
Étape 6 - Grain inoculation: day 3
The liquid inoculation is carried out on the clean substrate. Either the substrate is in a jar (as in the pictures) or the substrate is contained in a grow bag. In both cases, the mycelium must be able to breathe.
En cas de choix d'un bocal, percez son couvercle et nettoyez le à l'alcool 70°. Placez ensuite une compresse stérile dans l'orifice.
- Dans votre cuisine, nettoyez votre plan de travail à l’alcool.
- Allumez votre hotte et placez des bougies chauffe-plat tout autour de votre zone de travail.
- Allumez les bougies et sortez votre seringue de mycélium liquide du réfrigérateur, nettoyez (alcool 70°) et placez la au centre de la zone de travail.
- Sortez votre seringue et votre aiguille de leur sachet. Insérez l’aiguille.
- Prenez votre sac/bocal de grains stérilisés, nettoyez l’extérieur de ce sac/bocal à l’alcool 70° et placez le dans votre zone de travail.
(Attention à ce que le filtre/compresse ne touche pas d’alcool)
- Prenez deux compresses stériles et imbibez les d’alcool.
- Placez l’aiguille de votre seringue sur la flamme d’une des bougies et attendez que la pointe devienne rouge.
- Placez la ensuite entre les deux compresses imbibées d’alcool.
- Ouvrez votre sac/bocal dans la zone de travail et videz entièrement le mycélium de votre seringue sur vos grains.
- Fermez le sac/bocal immédiatement en pliant le dessus et fixez vos pinces à linge.
- Chassez l’air et placez le dans une boite non transparente à la température d’incubation adaptée à la variété (informations sur le site de Breizh Bell).
- Patientez le temps d’incubation adapté à la variété (14jours pleurotes, autres informations sur le site de Breizh Bell). Notez le dans votre agenda !
(vous pourrez regarder si votre mycélium colonise correctement vos grains au bout de quelques jours mais attention à la lumière !).
Le mycélium va se propager.
Votre culture est prête lorsque vos grains deviennent complètement blancs. La moindre tâche verte, bleue ou noir dans votre bocal est le signe d'une contamination et votre culture sera alors inutilisable.
Étape 7 - Transfert de grains : clonage ou fructification
Dès que vos grains sont colonisés, vous avez les deux possibilités suivantes :
- Transférer vos grains colonisés vers d'autres grains pour copie
- Transférer vos grains colonisés vers un substrat pour fructification
Étape 8 - Préparation de votre substrat (dès que vos grains sont bien colonisés)
Attention, les étapes suivantes ne sont valables que pour les pleurotes !
Cette étape va permettre au mycélium, déjà plus fort, de se faire la dent sur un substrat plus dur. Les pleurotes sont friands de sciure de bois feuillus ou de paille. Vous pouvez également associer les deux.
La litière naturelle (non odorisée) pour lapin est un substrat idéal et facile à trouver en magasins !
- Faites chauffer de l’eau dans votre casserole à feu doux, vous pouvez ajouter du marc de café (maximum 1/3 du volume du substrat et de maximum trois jours) à cette eau !
- Prenez un contenant et remplissez le avec de la sciure de bois feuillus et/ou de paille.
- Munissez vous de votre thermomètre et attendez que l’eau chaude atteigne 75°C (pasteurisation).
- Remplissez votre sac de substrat avec cette eau et refaites chauffer de l’eau à feu doux.
- Préchauffez votre four à 75° si vous constatez que votre contenant de substrat est trop volumineux pour votre casserole !
- Prenez votre thermomètre, et mesurez la température de l’eau., elle ne doit jamais dépasser les 93°C !
- Pour savoir si votre substrat est bien humidifié, prenez-en une bonne poignée dans la main et pressez-le. Il doit se détacher tout seul et ne pas rester en boule. Pour une meilleure compréhension, nous vous invitons à regarder la vidéo tuto « Bien mouiller son substrat ! »
- Fermez votre contenant (à l’aide de pinces à linge en bois en cas de sac).
- Plongez votre contenant dans l’eau, laissez-le pendant 2 heures à couvert et prenez la température de l'eau chaque demi-heure (<93°C) // Placez votre contenant dans votre four à 75°C pendant deux heures !
- Laissez-les refroidir une nuit et conservez-les fermés.
Étape 9 - Transfert des grains
Dans votre cuisine, nettoyez votre plan de travail à l’alcool.
- Allumez votre hotte et placez des bougies chauffe-plat tout autour de votre zone de travail.
- Prenez votre contenant de grains inoculés, le mycélium doit avoir coloniser l’ensemble des grains !
- Nettoyez l’extérieur du contenant de grains inoculés et le contenant de substrat refroidi avec de l’alcool.
- Ouvrez vos contenants au centre de la zone de travail.
- Cassez vos grains colonisés pour en faire des grumeaux, attention à ce que chaque instrument en contact soit nettoyé !
- Remplissez votre contenant de substrat avec vos grains inoculés. Fermez-le immédiatement (avec les pinces à linge, en chassant l’air en cas de sac).
- Replacez les contenants dans une pièce à une température comprise entre 20 et 23°C pendant trois semaines. Prêt d’un radiateur dans votre salle de bain est une solution astucieuse !
En cas de sac, placez le dans une boite isolée de la lumière.
Published










 Français
Français English
English Deutsch
Deutsch Español
Español Italiano
Italiano Português
Português